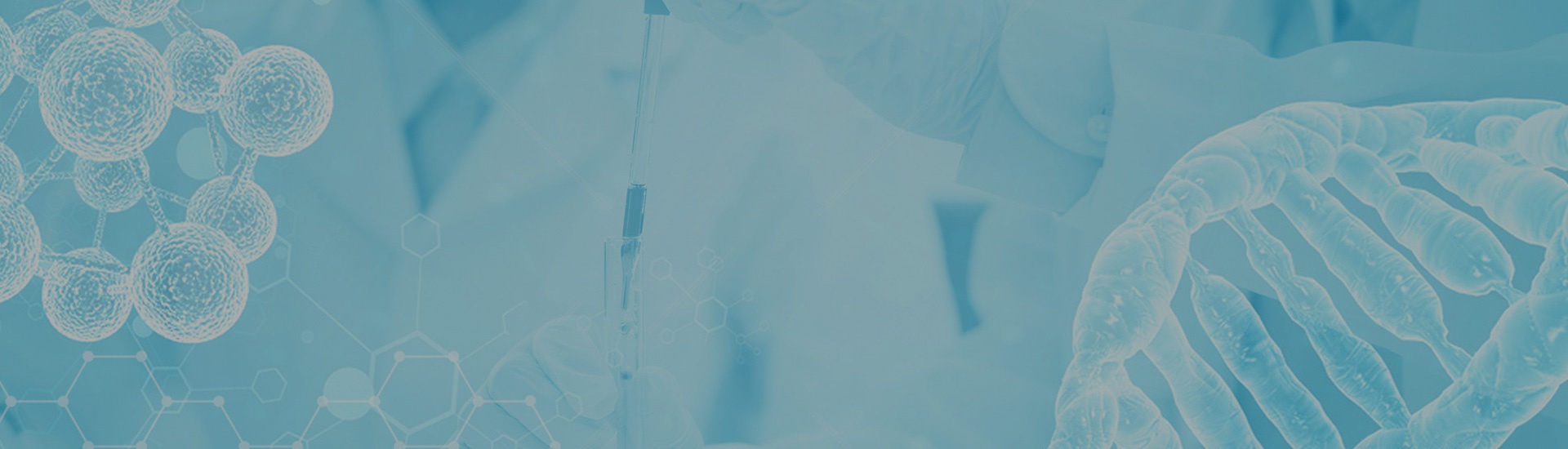
免疫組化(huà)
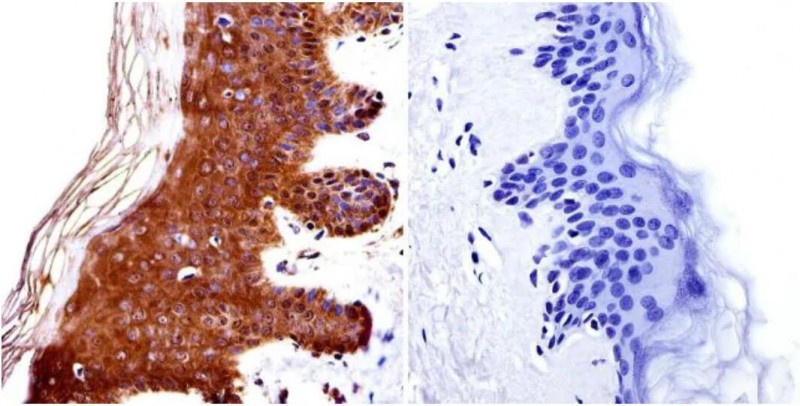
免疫組化(huà)
免疫組化(huà)
一,免疫組織化(huà)學簡介
免疫組織化(huà)學又稱免疫細胞化(huà)學,是指帶顯色劑标記的(de)特異性抗體在組織細胞原位通(tōng)過抗原抗體反應和(hé)組織化(huà)學的(de)呈色反應,對(duì)相應炕原進行定性、定位、定量測定的(de)一項新技術。它把免疫反應的(de)特異性、組織化(huà)學的(de)可(kě)見性巧妙地結合起來(lái),借助顯微鏡(包括熒光(guāng)顯微鏡、電子顯微鏡)的(de)顯像和(hé)放大(dà)作用(yòng),在細胞、亞細胞水(shuǐ)平檢測各種抗原物(wù)質(如蛋白質、多(duō)肽、酶、激素、病原體以及受體等)。
二,免疫組化(huà)技術的(de)基本原理(lǐ)
免疫組化(huà)技術是一種綜合定性、定位和(hé)定量;形态、機能和(hé)代謝密切結合爲一體的(de)研究和(hé)檢測技術。在原位檢測出病原的(de)同時(shí),還(hái)能觀察到組織病變與該病原的(de)關系,确認受染細胞類型,從而有助于了(le)解疾病的(de)發病機理(lǐ)和(hé)病理(lǐ)過程。
免疫酶組化(huà)技術是通(tōng)過共價鍵将酶連接在抗體上,制成酶标抗體,再借酶對(duì)底物(wù)的(de)特異催化(huà)作用(yòng),生成有色的(de)不溶性産物(wù)或具有一定電子密度的(de)顆粒,于普通(tōng)顯微鏡或電鏡下(xià)進行細胞表面及細胞内各種抗原成分(fēn)的(de)定位,根據酶标記的(de)部位可(kě)将其分(fēn)爲直接法(一步法)、間接法(二步法)、橋聯法(多(duō)步法)等,用(yòng)于标記的(de)抗體可(kě)以是用(yòng)免疫動物(wù)制備的(de)多(duō)克隆抗體或特異性單克隆抗體,最好是特異性強的(de)高(gāo)效價的(de)單克隆抗體。直接法是将酶直接标記在第一抗體上,間接法是将酶标記在第二抗體上,檢測組織細胞内的(de)特定抗原物(wù)質。目前通(tōng)常選用(yòng)免疫酶組化(huà)間接染色法。
三,免疫組化(huà)步驟
1,切片,烤片60℃,1h;
2,脫蠟及複水(shuǐ)
二甲苯10min,100%乙醇5min,95%乙醇5min,90%乙醇5min,85%乙醇5min,80%乙醇5min, 75%乙醇5min,60%乙醇5min,50%乙醇5min,30%乙醇5min,自來(lái)水(shuǐ)1min,雙氧水(shuǐ)1min;
3,1份30%H2O2加10份蒸餾水(shuǐ),室溫10min,蒸餾水(shuǐ)洗3次,每次3min;
4,微波修複
将切片浸入0.01M枸橼酸緩沖液,微波中最大(dà)火力(98℃-100℃)加熱(rè)至沸騰,冷(lěng)卻(約5-10min),反複兩次;
5,将切片自然冷(lěng)卻至室溫,PBS洗滌3次,每次5min;
6,封閉,5%BSA,室溫20min,甩去多(duō)餘液體;
7,滴加一抗,37℃,1h,或者4℃過夜;
8,PBS洗滌3次,每次3min;
9,滴加二抗,37℃,15-30min;
10,PBS洗滌3次,每次3min;
11,滴加SABC,37℃, 30min;
12,PBS洗滌3次,每次5min;
13,1ml蒸餾水(shuǐ)中分(fēn)别滴加顯色劑,混勻;
14,DAB顯色劑配置好後,滴加于切片,室溫,鏡下(xià)檢測反應時(shí)間(約5min);
15,自來(lái)水(shuǐ)沖洗幹淨,過蒸餾水(shuǐ);
16,蘇木(mù)素複染2min,自來(lái)水(shuǐ)沖洗;
17,脫水(shuǐ)
30%乙醇3min,50%乙醇3min,70%乙醇3min,80%乙醇3min,90%乙醇3min,95%乙醇3min,100%乙醇3min,二甲苯20min;
18,樹膠封片,鏡檢。
四,免疫組化(huà)常見問題分(fēn)析
1,石蠟切片在染色過程中出現脫片現象
1)烤片時(shí)間不夠,或溫度不夠,可(kě)以延長(cháng)烤片時(shí)間和(hé)提高(gāo)烤片溫度;
2)用(yòng)含有多(duō)聚賴氨酸的(de)玻片,可(kě)以購(gòu)買到或這(zhè)自己做(zuò);
3)有些組織本身就容易掉片,如骨組織等,操作時(shí)沖PBS不要直接沖到組織上,沖到組織上方,讓它流下(xià)沖洗組織;
4)用(yòng)高(gāo)溫修複時(shí),溫度驟冷(lěng)也(yě)可(kě)能引起。
2,邊緣效應
1)組織邊緣與玻片粘貼不牢,邊緣組織松脫漂浮在液體中,每次清洗不易将組織下(xià)面試劑洗盡所緻. 解決辦法:制備優質的(de)膠片(APES或多(duō)聚賴氨酸),切出盡量薄的(de)組織切片,不厚于4微米,組織的(de)前期處理(lǐ)應規範,盡量避免選用(yòng)壞死較多(duō)的(de)組織;
2)切片上滴加的(de)試劑未充分(fēn)覆蓋組織,邊緣的(de)試劑容易首先變幹,濃度較中心組織高(gāo)而緻染色深。解決辦法:試劑要充分(fēn)覆蓋組織,應超出組織邊緣2mm。用(yòng)組化(huà)筆畫(huà)圈時(shí),爲了(le)避免油劑的(de)影(yǐng)響,畫(huà)圈應距組織邊緣3-4mm。
3,産生組織切片非特異性染色
1)抗體孵育時(shí)間過長(cháng)、抗體濃度高(gāo)易增加背景著(zhe)色。這(zhè)可(kě)通(tōng)過縮短一抗/二抗孵育時(shí)間、稀釋抗體來(lái)控制。這(zhè)是最重要的(de)一條;
2)一抗用(yòng)多(duō)克隆抗體易出現非特異性著(zhe)色,建議(yì)試用(yòng)單克隆抗體看看;
3)内源性過氧化(huà)物(wù)酶和(hé)生物(wù)素在肝髒、腎髒等組織含量很高(gāo)(含血細胞多(duō)的(de)組織),需要通(tōng)過延長(cháng)滅活時(shí)間和(hé)增加滅活劑濃度來(lái)降低背景染色;
4)非特異性組分(fēn)與抗體結合,這(zhè)需要通(tōng)過延長(cháng)二抗來(lái)源的(de)動物(wù)免疫血清封閉時(shí)間和(hé)适當增加濃度來(lái)加強封閉效果;
5)DAB孵育時(shí)間過長(cháng)或濃度過高(gāo);
6)PBS沖洗不充分(fēn),殘留抗體結果增強著(zhe)色,在一抗、二抗或SP孵育之後的(de)浸洗尤爲重要;
7)标本染色過程中經常出現幹片,這(zhè)容易增強非特異性著(zhe)色。
4,免疫組化(huà)染色呈陰性結果
1)抗體濃度和(hé)質量問題以及抗體來(lái)源選擇錯誤;
2)抗原修複不全,對(duì)于甲醛固定的(de)組織必須用(yòng)充分(fēn)抗原修複來(lái)打開抗原表位,以利于與抗體結合;建議(yì)微波修複用(yòng)高(gāo)火4次*6min試試。有人(rén)做(zuò)過實驗,這(zhè)是最佳的(de)時(shí)間和(hé)次數。若不行,還(hái)可(kě)高(gāo)壓修複;
3)組織切片本身這(zhè)種抗原含量低;
4)血清封閉時(shí)間過長(cháng);
5)DAB孵育時(shí)間過短;
6)細胞通(tōng)透不全,抗體未能充分(fēn)進入胞内參與反應;
7)開始做(zuò)免疫組化(huà),我建議(yì)你一定要首先做(zuò)個(gè)陽性對(duì)照(zhào)片,排除抗體等外的(de)方法問題。
5,背景
1,考慮一抗濃度高(gāo);
2,然後調整DAB孵育時(shí)間;
3,也(yě)要考慮血清封閉時(shí)間是否過短;
4,适當增加抗體孵育後的(de)浸洗次數和(hé)延長(cháng)浸洗時(shí)間等。
文章(zhāng)來(lái)源網絡整理(lǐ),如有侵權及時(shí)聯系